中国首个TCR-T细胞疗法TAEST16001治疗晚期软组织肉瘤疾病控制率达83.3%
手术、放疗、化疗作为传统治疗手段虽然能在一定程度上改善患者的生存率及预后,但仍然无法革命性地改善患者的生存情况。当在血液瘤中成功后,大家开始将CAR-T技术应用于实体瘤治疗但是阻力较多。
CAR-T细胞和TCR-T细胞都属于经基因工程技术改造的T细胞。相较于CAR-T疗法,T细胞受体基因工程改造的T细胞(TCR-T)免疫疗法是通过改造自体T细胞中靶向肿瘤的特异性抗原来杀伤肿瘤细胞的。因其在实体瘤中的成功应用,目前被认为是最有前景的免疫治疗方式之一。
2023年8月15日,国际知名期刊《Cell Reports Medicine》发布了关于中国首个获批临床试验的TCR-T疗法TAEST16001的I期临床研究成果。
据悉,TAEST16001作为一款TCR-T细胞疗法,于2019年首次获批临床试验申请(IND),用于治疗软组织肉瘤,目前已经进入临床2期。

截图源自杂志官网
疾病控制率达83.3%!中国首个TCR-T疗法初战告捷
该产品首个I期临床试验旨在探究TAEST16001细胞在HLA-A*02:01阳性并且表达NY-ESO-1抗原的晚期软组织肉瘤患者中进行的剂量递增和拓展性研究。
从2020年3月23日~2021年12月31日,该研究共纳入12例晚期软组织肉瘤患者,其中滑膜肉瘤10例,脂肪肉瘤2例(黏液样脂肪肉瘤1例,去分化脂肪肉瘤1例)。其中83.3%的患者既往接受过至少2种化疗。
所有接受规定细胞剂量的 TAEST16001 的12例患者均符合疗效分析的条件,其中 9 例 (75%) 患者显示肿瘤消退。在该试验中输注 TAEST16001 细胞的患者表现出中位缓解时间 (TTR) 为 1.9 个月,中位缓解持续时间为 13.1 个月。6例 (50%) 患者在第一次放射学评估后肿瘤负荷持续下降。
在主要分析时,最佳缓解为12例患者中的5例部分缓解,客观缓解率为41.7%,5例患者疾病稳定,疾病控制率为83.3%。80%无肺转移的患者有部分缓解。中位无进展生存期(PFS)为 7.2 个月。
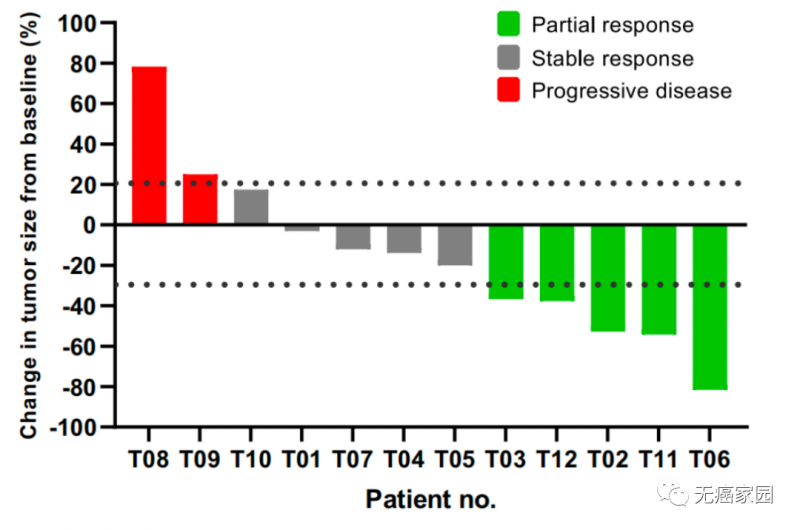
图为单个可评估患者的最佳临床反应
此次研究成果得到专业人士的高度评价,认为TAEST16001的I期临床研究为过继性T细胞免疫疗法在晚期软组织肉瘤的临床转化中迈出关键一步,让我们期待这款TCR-T疗法后续临床研究成果!
如何寻求TCR-T疗法及其他疗法?>>
目前正有几款研发的TCR-T疗法在招募乙型肝炎病毒相关肝细胞癌患者、一款HPV16阳性的TCR-T疗法在招募晚期宫颈癌、肛门癌、头颈部肿瘤(口腔癌、喉癌等)患者开展临床试验,想要参加的患者可提交病理报告、治疗经历、出院小结等资料至无癌家园医学部初步评估病情。
此外,若想咨询其他细胞疗法(CAR-T、NK、CAR-NK、CTL、TILs等疗法)的患者,同样可将病理报告及治疗经历、出院小结等资料提交至无癌家园医学部,详细评估病情。







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城